金属材料に求められる要求特性は多種多様であり、様々な金属を加えた合金や熱処理技術などを組み合わせて実現されています。
見た目は均一な様に見える鋼材も、ミクロな目で見ていくとそこには金属の結晶構造や原子の世界が現れます。
ここでは、金属の原子レベルの世界から、鉄(Fe)に炭素(C)などを加えて強くしたり、金属結晶と塑性変形の関係や高温にすると性質が変わることなどについて説明します。
金属原子の並び方(結晶構造)
金属の強さについて考えるために、金属の結晶構造について簡単に説明します。
ここで、原子を一番外側の電子の軌道面を球面とするボールと仮定します。金属は結晶ですから、このボールが三次元にきちんと並んでいます。この並びかたの代表的な結晶構造として、面心立方格子、体心立方格子と六方最密格子を下図に示します。
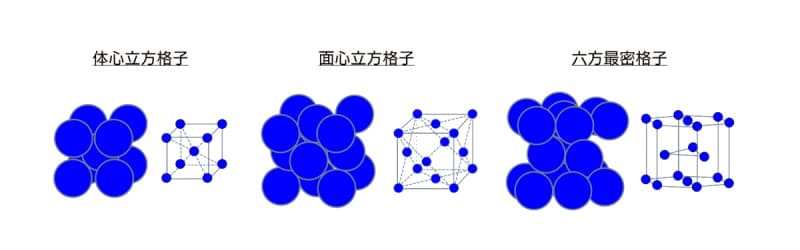
代表的な結晶構造
図 代表的な結晶構造
上図から、次のことが分かります。
- 体心立方格子は、1つの格子(立法体)の中心に原子が1個あります。
- 面心立方格子は、1つの格子(立法体)の各面の中心に1個の計6個あります。
このことから単純に比較はできまないのですが、体心立方格子の方が、面心立方格子より原子数が多いため結晶構造としては変形しにくい(硬い)と考えることができます。
鋼の強さや変形について考える場合に、鉄(Fe)と炭素(C)などの他の元素からなる結晶構造から考えることもできるということです。
例えば、鋼(鉄-炭素)のα層は、体心立方格子、γ相は面心立方格子なので、同様に考えることができます。様々な金属の違いを金属の結晶構造で考えてみると金属の性質について別の見方ができそうです。

金属としての性質には。例えば、格子の辺の長さ(格子定数)なども関係しています。
下表に、下表に、鋼材や添加剤に使われる主な金属の結晶構造を示します。
| 結晶構造 | 主な金属原子 |
|---|---|
| 体心立方格子 | クロム(Cr)、アルファ鉄(Fe(α))、ナトリウム(Na)、モリブデン(Mo)、バナジウム(V) |
| 面心立方格子 | 金(Au)、銀(A)、銅(Cu)、アルミニウム(Al)、ガンマ鉄(Fe(γ))、ニッケル(Ni) |
| 六方最密格子 | 亜鉛(Zn)、チタン(Ti)、マグネシウム(Mg)、コバルト(Co) |
体心立方格子:BCC(Body-Centered Cubic lattice)
面心立方格子:FCC(Face-Centered Cubic lattice)
六方最密格子:HCP(Hexagonal Close-Packed lattice)

この原稿を書いている時、今でも元素記号を見て何かが分かるのは、高校での化学が好きだったせいかもしれません。溶液に含まれている元素の種類を調べる実験はおもしろかったことを思い出します。
金属の格子欠陥から転移と塑性変形による硬化
日常的に目にする金属は多結晶体、つまり多数の結晶からなるのですが、1つ1つの原子がそれぞれの結晶構造にしたがい整然と並んでいるわけではありません。
金属に力を加えた時に金属組織(結晶構造)はどの様な影響を受けるかについて説明します。
下図は、金属片(試験片)の両端を引っ張った場合のイメージです。
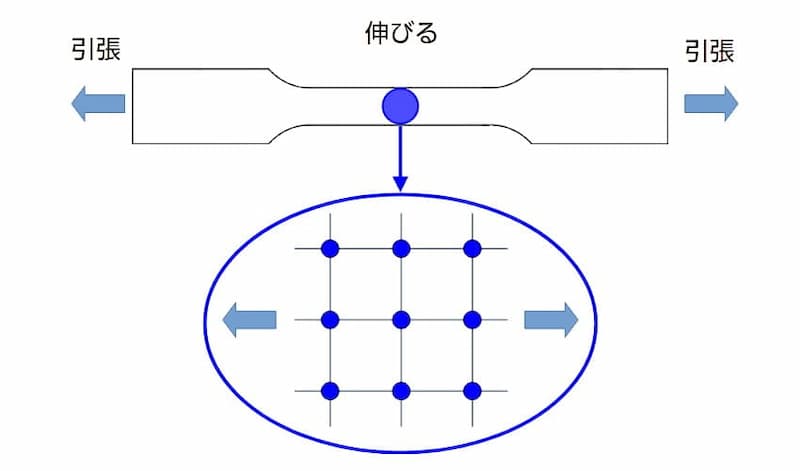
金属片(試験片)を引っ張った場合の金属組織のイメージ
図 金属片(試験片)を引っ張った場合の金属組織のイメージ
上図は、金属組織が格子状に整然と並んでいますが、実際の金属では下図の様に原子が抜けた部分(格子欠陥)があります。
格子欠陥の位置は、外力を加えることで移動していき、これを転移といいます。
ここで転位が単結晶の粒界や材料の表面に達すると、その部分の新しい表面となるためそれ以上転移できなくなります。このことは、言い換えると次の様になります。
- 新しい表面が生じたということは、そこで表面からエネルギーが熱として放出されたと考えられます。
- エネルギーを失うと、力を抜いたり逆向きに与えたくらいでは、飛び出した結晶面は決して内側には戻らなくなります。つまり塑性変形ということです。
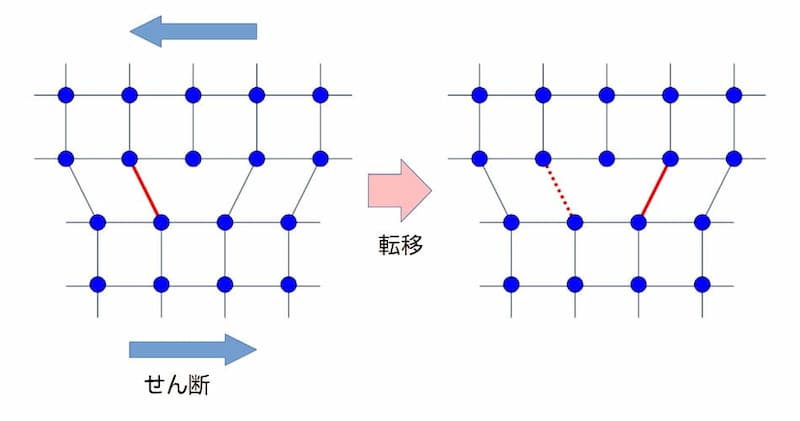
外力によ金属組織の転移のイメージ
図 外力によ金属組織の転移のイメージ
金属組織の転移と塑性変形
塑性変形をすると金属は硬くなります。これは、転移ができなくなる、つまり、それ以上原子が移動できなくなるため硬くなったと考えることができます。
下図は、金属組織の両端を引っ張った場合の金属組織の変化のイメージ図です。
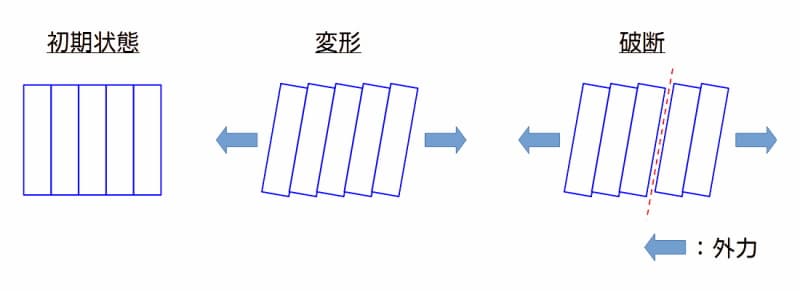
金属の塑性変形から破断のイメージ
図 金属の塑性変形から破断のイメージ
上図より、次のことがいえます。
- 下図左側の金属組織は、金属結晶が結合した状態を示しています。
- 下図中央は、左右に引っ張っていき塑性変形となった状態です。
- さらに引っ張っていくと、下図右側の様に金属の結晶の境界から破断します。
金属の特性と格子欠陥
金属組織には格子欠陥があります。格子欠陥の部分は、金属組織内の原子同士のすき間であり、ここに別の原子が入りこむと、入り込んだ原子により転移を妨げるため、金属材料としては塑性変形しにくく金属としては強くなります。
例えば、鉄(Fe)に炭素(C)などは入り込むと、金属が硬くなります。
さて、金属材料には、何らかの異なる元素(不純物の元素)が含まれています。むしろ、例えば鉄(Fe)のみを含む純金属の方が特殊だといえます。

ここでは説明しませんが、鉄(Fe)の純度が高まると別の性質を発揮します。
そこで、鉄(Fe)に他の元素を加えることで、様々な用途に適した性質をもつ合金(鉄鋼材料)を作ることができます。
なお、合金の金属組織の混ざり具合には、次の様なものがあります。
- それぞれの金属結晶が混ざりあっている。
- 完全に混ざり合っている(溶け合っている)(固溶体)
- 特定の割合で混ざり合い複雑な結晶構造となる。
ある金属組織に別の金属原子が混ざりあう場合、下図の様に侵入形と置換形とに分けられます。
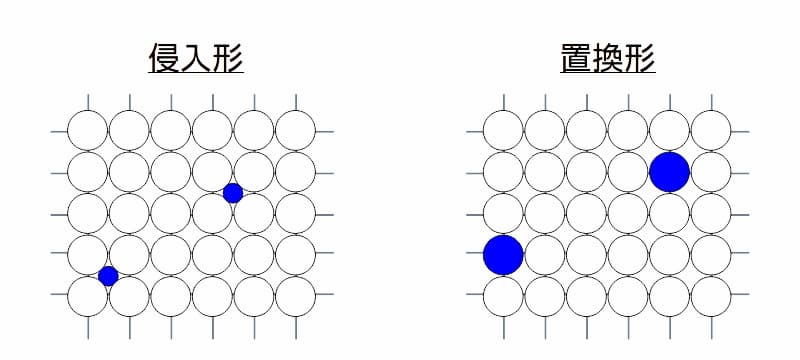
金属組織内への原子の入り方のイメージ
図 金属組織内への原子の入り方のイメージ
侵入形とは、元となる金属組織のすき間に、別の原子が入り込み(溶け込み)ます。この場合、入り込む原子は小さなものになります。
- 例えば鉄(Fe)の場合、炭素(C)、酸素(O)、水素(H)や窒素(N)などが溶け込みます。
置換形とは、元となる金属組織内の金属原子と、別の金属原子が入れ換わります。
- 例えば鉄(Fe)の場合、クロム(Cr)やニッケル(Ni)などが置換します。
金属の温度と原子の動きやすさ
温度が金属組織(金属の原子)に与える影響について説明します。
鉄鋼の中の炭素原子は、鉄の結晶格子間に侵入形で溶け込んでいます。また、常温において炭素原子はほとんど固溶していません。
ここでは下図の立方体の結晶構造を例に、金属結晶の温度の影響について説明します。
下図において、金属結晶間の結合をばねで表しています。
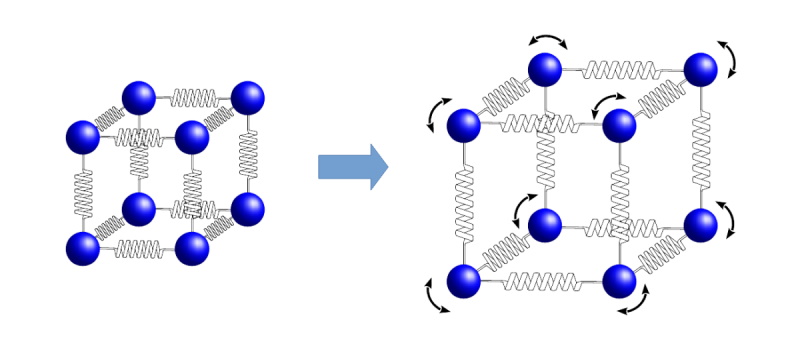
金属原子の動きやすさと温度のイメージ
図 金属原子の動きやすさと温度のイメージ
上図より、次のことがいえます。
- 常温では、ばねにより金属原子間は強固に結合されており、ほとんど動きません。
ここで、金属の温度を上げていくと、ばねによる結合力が小さくなり、金属原子が動きやすくなります。つまり金属を高温にすると、次の様な現象が生じます。
- 金属原子間の結合力が小さくなる(硬さが低下する)。
- 金属原子間の距離が長くなり金属原子間の空間が広がることで、常温よりも金属原子が溶け込みやすくなる(常温よりも大きい原子、同じ大きさであれば多量の原子が溶け込みやすくなる)。
- 金属原子が動きやすくなることで、歪みを持った結晶構造に再配列が生じたり、残留応力が開放されたり、再結晶化が進んだりする。
鋼の中の炭素原子の移動(拡散)
鋼の基本成分は、鉄(Fe)と炭素(C)です。鋼の中に炭素は浸入形で溶け込んでいますが、この炭素原子は常温ではほとんど動きません。
しかし、鋼の温度が高くなると、炭素原子は常温の時よりも自由に鉄の結晶中を動くことができるようになります。これを拡散といいます。
置換形の拡散のイメージを下図に示します。
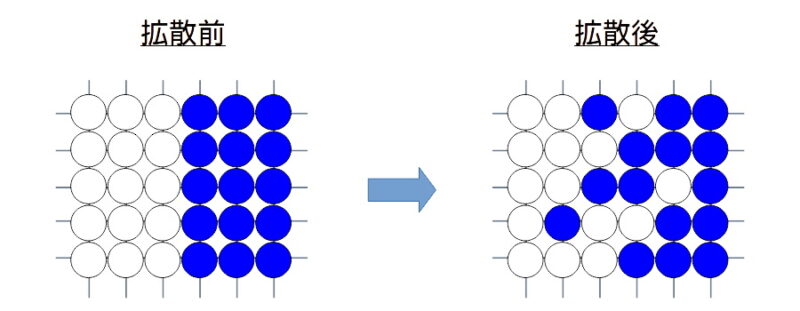
置換形の金属原子拡散のイメージ
図 置換形の金属原子拡散のイメージ
まとめ
金属材料は多種多様な特性が求められ、様々な金属を加えた合金や熱処理技術などを組み合わせて実現されています。
見た目は均一な様に見える鋼材も、ミクロな目で見ていくとそこには金属の結晶構造や原子の世界が現れます。
ここでは、金属の原子レベルの世界から、鉄(Fe)に炭素(C)などを加えて強くしたり、金属結晶と塑性変形の関係や高温にすると性質が変わることなどについて以下の項目で説明しました。
- 金属原子の並び方(結晶構造)
- 金属の格子欠陥から転移と塑性変形による硬化
- 金属組織の転移と塑性変形
- 金属の特性と格子欠陥
- 金属の温度と原子の動きやすさ
- 鋼の中の炭素原子の移動(拡散)